Le virus de l’immunodéficience humaine (VIH) affecte environ 33 millions d’individus mondialement [ 12]. Ce virus infecte les cellules CD4+ ; il est la cause du Sida (syndrome d’immunodéficience acquise), au cours duquel la perte des cellules lymphocytaires T CD4+, principaux agents de défense immunitaire, ouvre la voie aux infections opportunistes. Malgré de considérables travaux de recherche scientifique, les réactions immunitaires idéales qu’un vaccin devrait être en mesure de stimuler afin de maîtriser ou d’éradiquer le VIH demeurent toujours à l’état de perspective. Dans le but d’éclaircir la question, il est possible d’étudier l’unicité de certains individus qui, soit semblent résister à l’infection malgré de multiples contacts avec les virus (les exposés séronégatifs ou ESN), soit progressent plus lentement vers la maladie une fois infectés. Pour les deux types de populations, un certain nombre de publications récentes soulignent le rôle qu’auraient les cellules NK (natural killer) pour enrayer les effets du VIH [ 1– 4].
Les cellules NK sont des cellules de l’immunité innée qui font partie des premières lignes de défenses contre les infections virales et les tumeurs [ 5]. Les fonctions cytotoxique et sécrétrice des cytokines de ces cellules sont régulées par l’intégration de signaux intracellulaires inhibiteurs ou activateurs, transmis par des récepteurs NK se trouvant à la surface de la cellule [ 6]. Les KIR (killer immunoglobulin-like receptor) constituent une famille de récepteurs NK comprenant à la fois des membres inhibiteurs et activateurs dont certains, comme le KIR inhibiteur KIR3DL1 (ci-après 3DL1), ont été liés au dénouement de certaines maladies infectieuses [ 7].
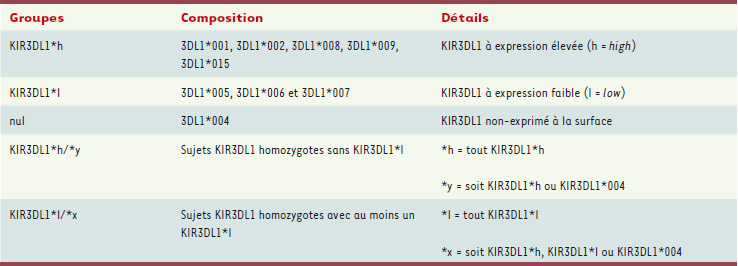
Les multiples allèles 3DL1 peuvent être sous-catégorisés en trois groupes selon leurs niveaux d’expression à la surface de la cellule NK [1, 8] (Tableau I). Donc, pour les individus homozygotes 3DL1, il est possible de créer deux classes de sujets en fonction de l’absence (3DL1*h/*y) ou de la présence (3DL1*l/*x) d’un allèle à expression faible qui, par suite de certains changements dans la séquence des acides aminés, produit une protéine plus faiblement exprimée à la surface de la cellule [1]. La présence d’un seul allèle 3DL1*l est nécessaire et suffisante pour diminuer significativement l’expression de 3DL1 à la surface des cellules NK d’un individu et vraisemblablement faire décroître la somme des signaux transmis par ce récepteur.
| Tableau I.
Les groupes KIR3DL1. Définition et groupement des sous-types de KIR3DL1 en fonction de leur niveau d’expression à la surface cellulaire : élevé, faible ou nul. |
Puisque le ligand pour 3DL1 est le complexe majeur d’histocompatilibité (CMH) de classe IB du sérotype Bw4, l’interaction entre les produits de ces deux gènes détermine le niveau fonctionnel des cellules NK d’un individu dans le contexte d’une maladie infectieuse. Par exemple, il a récemment été démontré que les individus infectés par le VIH progressaient plus ou moins rapidement vers le Sida en fonction des différentes combinaisons de 3DL1 et de CMH (ou HLA chez l’humain - human leukocyte antigen) [1]. L’interaction entre 3DL1*h/*y et HLA B*57 [1] a pour effet de ralentir la progression vers la maladie. Toutefois, cette même interaction génétique confère-t-elle au sujet qui en bénéficie un certain niveau de résistance au VIH réduisant ainsi sa susceptibilité à l’infection ?
Afin de pouvoir répondre à cette question, nous avons comparé la proportion de sujets porteurs des gènes 3DL1*h/*y et HLA B*57 dans deux groupes d’individus [ 9]. Le premier groupe, de 41 ESN, était composé de personnes recrutées soit à partir d’une cohorte d’utilisateurs de drogues injectables (UDI), soit à partir de couples sérodiscordants pour le VIH. Les ESN ont rapporté un minimum de 5 expositions directes au VIH et aucun d’entre eux n’était homozygote pour une mutation dont on connaît déjà l’effet sur la diminution des risques d’infection, la mutation CCR5Δ32. Cette délétion de 32 paires de bases du gène CCR5 produit un co-récepteur du VIH qui n’est pas exprimé à la surface des cellules, rendant ainsi les individus homozygotes pour cette mutation résistants à l’infection [ 10]. Le deuxième groupe était composé de 186 individus, provenant d’une cohorte de sujets en primo-infection (PI) du VIH. Ce groupe a été choisi comme contrôle en raison de deux de ses caractéristiques : (1) ces individus sont clairement susceptibles au VIH, (2) chez ces individus la distribution génétique des KIR et des HLA n’a pas encore été affectée par la progression de la maladie.
Lorsque la distribution génétique a été comparée, nous avons observé que 12,2% des ESN et seulement 2,7% des individus en primo-infection portaient à la fois 3DL1*h/*y et HLA B*57. Notre étude tend à montrer que le risque d’infection par le VIH est près de 5 fois moins élevé chez les personnes porteuses de ces deux allèles comparativement à celles dotées d’un seul ou d’aucun de ces allèles.
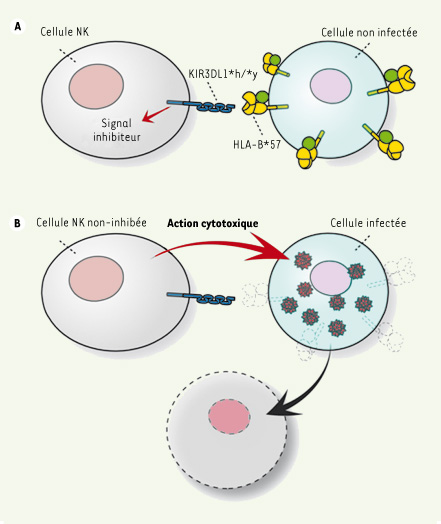
Le mécanisme expliquant ce résultat n’est pas encore établi. Cependant, puisque le génotype 3DL1*h/*y est défini par l’expression élevée des récepteurs à la surface des cellules NK et que l’interaction entre B*57 et 3DL1*h/*y est de grande affinité, le signal inhibiteur reçu par les cellules NK dans ce contexte génétique est puissant lorsqu’il n’y a pas d’infection (Figure 1A). Puisque la protéine virale Nef diminue l’expression des molécules CMH de classe IA et B à la surface des cellules infectées, lorsqu’il y a infection par le VIH (Figure 1B), où l’expression du ligand B*57 est affaiblie, les cellules NK positives pour 3DL1*h/*y perdent leur signal inhibiteur, deviennent fortement activées et peuvent amorcer la lyse des cellules infectées [ 11]. Les particularités des gènes B*57 et 3DL1*h/*y, menant à une inhibition forte des cellules NK dans un contexte de non-infection et d’une activation forte de ces mêmes cellules lors d’une infection, expliquent probablement pourquoi nous avons découvert un effet de protection contre l’infection lié à cette combinaison génétique et non pour d’autres combinaisons de récepteurs KIR et de ligands HLA. Finalement, il faut noter que cette protection n’est pas absolue puisqu’il y a des individus VIH séropositifs qui portent le même génotype. Toutefois, ceux-ci, une fois infectés, progressent plus lentement vers le Sida [1].
| Figure 1.
Modèle d’action de KIR3DL1*h/*y et HLA-B*57 contre le VIH. Lorsqu’une cellule n’est pas infectée (A), le niveau de HLA-B*57 exprimé à la surface est normal, ce qui permet une forte interaction avec KIR3DL1*h/*y à la surface des cellules NK. Un signal inhibiteur dans la cellule NK prévient ensuite l’action cytotoxique. Lorsque la cellule est infectée (B), il y a une diminution des molécules HLA de classe I (incluant B*57) exprimées à la surface. Dans cette situation, il ne peut y avoir de signal inhibiteur, et la cellule infectée est éliminée. |
Ces données démontrent que l’immunité innée, particulièrement celle attribuable aux cellules NK, peut jouer un rôle dans la protection contre l’infection par le VIH. Cette percée souligne l’importance de la recherche sur la manipulation du système immun inné dans la perspective de la mise au point d’un vaccin prophylactique.